Kjemisk institutt Send e-post
- Atommasse:
- 10,81
- Fase (ved 25 °C):
- Fast
- Smeltepunkt:
- 2075 °C / 2348 K
- Kokepunkt:
- 4000 °C / 4273 K
- Gruppe:
- 13
- Periode:
- 2
- Blokk:
- p
- Elektronkonfigurasjon:
- [He]2s<sup>2</sup>2p<sup>1</sup>
- Elektronegativitet:
- 2,04
- Tetthet (ved 25 °C):
- 2,34 g/cm³
Bor
Bor er et svartglinsende, sprøtt og hardt stoff, faktisk det hardeste grunnstoffet etter diamant. Bor befinner seg på grensen mellom metallene og ikke-metallene, og det gjør at det har trekk fra begge grupper, noe som gir det uvanlige egenskaper.
Anvendelser
Grunnstoffet er som nevnt svært hardt, og kan derfor benyttes i boreverktøy. Et enda hardere stoff er bornitrid BN, som har tilsvarende struktur som grafitt. På samme måte som det er mulig å omdanne grafitt til diamant er det mulig å omdanne bornitrid til borazon som er like hardt som diamant.
Smeltet boraks har blitt benyttet i glasur på keramikk siden 300-tallet (i Kina). Boraks og borsyre brukes i dag i store kvanta som både bløtgjørings- og blekemidler i vaskemiddler, i form av perborater.
Glass har vært tilsatt boraks siden romertiden. Glass av borsilikat (sammensmelting av B2O3 og SiO2) har høy brytningsindeks og egner seg derfor godt til optiske linser, f.eks. teleskop. Pyrex-glass er annen viktig anvendelse av borsilikat. Slikt glass kan varmes og kjøles hurtig uten å sprekke, og har dessuten høy bestandighet mot sterke syrer og baser. Pyrex-glass benyttes mye både på kjøkkenet og i laboratoriet. Glassfiberarmert plast er et annet eksempel på bruk av borsilikat.
Boraks blir dessuten brukt som loddepasta (fjerner oksidbellegg på metalloverflatene som skal loddes sammen).
Amorft bor gir en karakterisk grønnfarge når det brenner, og brukes i fyrverkeriindustrien.
![[Foto: Barloworld Scientific] [Foto: Barloworld Scientific]](https://www.mn.uio.no/kjemi/tjenester/kunnskap/periodesystemet/B/pyrex.jpeg)
Bor brukes i moderatorstaver i kjernereaktorer på grunn av det høye innfangningstverrsnittet for nøytroner til isotopen 10B. Bor benyttes som tilsats til stål for å øke hardheten, og som dopant i halvlederindustrien.
I kroppen
Giftigheten til bor og borforbindelser varierer. Boraner er giftige, mens borater er foholdsvis lite giftige. Et menneske tåler normalt ikke inntak av 5 g boraks uten å bli syk. Det er uklart om bor inngår i noen prosesser i menneskekroppen.
Man kjenner et naturlig antibiotikum som inneholder bor, nemlig boromycin.
I miljøet
Bor er et viktig mikronæringsstoff for alle karplanter. Dette har vært kjent siden 1923. Bormangel fører til en rekke plantesykdommer. Man antar at borsyre har en viktig rolle i membraner og cellevegger, uten at den nøyaktige virkningsmekanismen er kjent.
Navn
Navnet bor stammer fra persisk (burah = boraks).
Historie
Boraks var kjent av babylonerne allerede for 6000 år siden, og egypterne, kineserne, tibetanerne og araberne brukte stoffet til mange ulike formål. Egypterne benyttet natron, som også inneholdt boraks, ved mumifisering. I middelalderen ble boraks innført til Europa fra Tibet (fra sjøen Yamdok som ligger sør for Lhasa) under navnet tinkal.
Selv om borsyre var blitt framstilt allerede i 1702, var det først i juni 1808 at franskmennene Louis-Joseph Gay-Lussac og Louis-Jacques Thénard klarte å fremstille bor bare ni dager før engelskmannen Humphrey Davy uavhengig av disse gjorde det samme. Både franskmennene og engelskmannen benyttet natrium eller magnesium for å redusere borsyre (se under framstilling), men stoffet var langt fra reint, i høyden 50 %. Det var Jöns Jakob Berzelius som i 1824 var den første til å identifisere bor som et grunnstoff, og først i 1892 var Henri Moissan i stand til å framstille forholdsvis reint bor, det vil si over 95 %.
Fremstilling
Framstilling av bor fra boraks foregår i flere steg. Først omsettes boraks med svovelsyre. I denne prosessen dannes borsyre:
Na2[B4O5(OH)4]*8H2O + H2SO4 --> 4B(OH)3 + 3H2O (Trinn 1)
Ved kraftig oppvarming dehydratiseres borsyre, og man står igjen med boroksid:
2B(OH)3 --> B2O3 + 3H2O (Trinn 2)
Deretter reduseres boroksid med magnesium:
3Mg + B2O3 --> 2B + 3MgO (Trinn 3)
En alternativ metode til (3) er elektrolyse av KBF4 i saltsmelte.
Svært ren bor kan fremstilles ved reduksjon av borbromid med hydrogen i gassfase, eller ved hydrolyse av B2H6 eller borjodid.
Forekomst
I likhet med sine nærmeste naboer i periodesystemet litium og beryllium dannes ikke bor i stjerner, og en antar derfor at det ble dannet i det store smellet da universet oppstod. Den universelle forekomsten er lav — kun en milliarddel av hydrogenets. I jordskorpa og i verdenshavene finner vi omlag 3 ppm (parts per million) bor. Hovedkildene til bor er boraks, Na2[B4O5(OH)4]*8H2O og kernitt, Na2[B4O5(OH)4]*2H2O. Det er betydelige forekomster i Tyrkia og i Mojaveørkenen (California, USA).
Kjemien

Bor er et svartglinsende, sprøtt og hardt stoff, faktisk det hardeste grunnstoffet etter diamant. Det har lav elektrisk ledningsevne, og er en halvleder. De kjemiske egenskapene til bor er komplekse og spennende og gjør at stoffet befinner seg på grensen mellom metallene og ikke-metallene. Selve grunnstoffet er kjemisk inert, men reagerer med fluor (F2) og salpetersyre.
Les mer om kjemienKjemiske bindinger
Uvanlige molekylstrukturer og allotrope
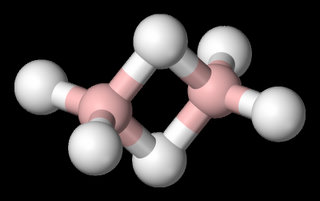
Som nevnt i innledningen er boratomer spennende fordi de danner uvanlige molekylstrukturer. Utgangspunktet er at boratomet er lite med tre valenselektroner. Dermed danner bor tre bindinger, som i borklorid. I gassfasen er borhydrid, BH3, kjent, men ustabil. To slike molekyler danner spontant en ny forbindelse, boran, B2H6, som har en uvanlig molekylstruktur der to av hydrogenatomene danner broer mellom boratomene.
BH3 danner forøvrig komplekser med elektrondonerende forbindelser, f.eks. H3BNH3. I slike komplekser er det ganske sterke B–N bindinger.
Allotrope former
Den mest stabile formen er &b-romboederformen. Den er bygget opp av blokker som består av 84 boratomer. En slik blokk består av tre lag. Det innerste laget er en ikosaedrisk B12-enhet. I det midterste laget er det også 12 boratomer som er bundet til hvert sitt atom i det innerste laget. Det ytterste laget er en B60-enhet med samme struktur som C60.
I tillegg til denne formen finnes det tre andre allotrope former.